近日,金沙9001cc以诚为本首页孙金鹏教授课题组和于晓教授课题组在GPCR对生殖系统的调控研究中取得新进展,研究成果“Gq activity- and β-arrestin-1 scaffolding- mediated ADGRG2/CFTR coupling are required for male fertility”以金沙9001cc以诚为本首页为第一单位,山东大学孙金鹏教授,于晓教授和华东师范大学李大力教授为共同通讯作者,2月3日在线发表于《eLife》(1区期刊,5年影响因子IF: 8.4)。
不孕不育已成为威胁人类健康和生活质量的重大问题。对男性生育机制的研究往往因为其生殖系统的复杂性而难以开展。比如,精子需要在输出小管和附睾阶段成熟并获能,但其调控机制尚不清楚,尤其是小管内液重吸收的过程。
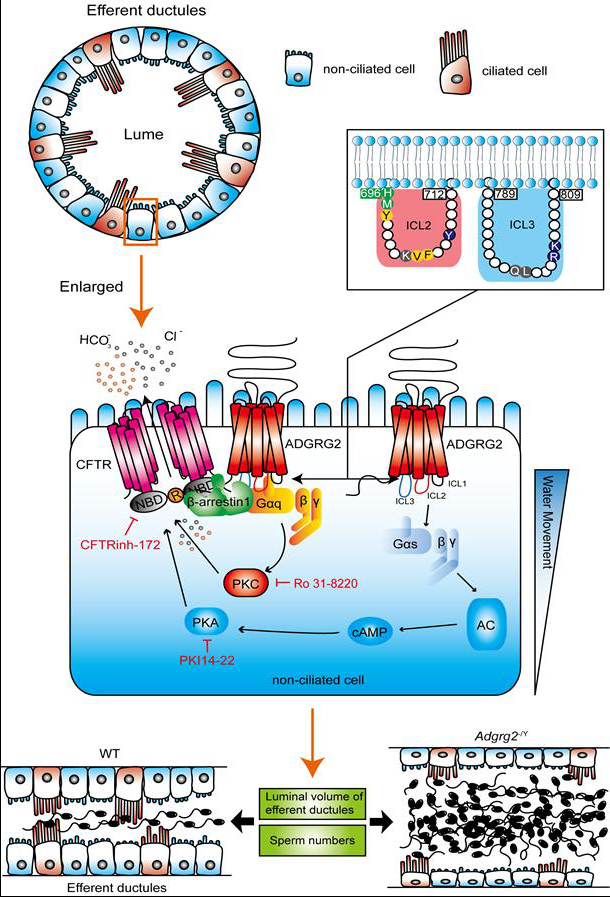
针对这一科学问题,孙金鹏教授课题组多年对GPCR研究的积累,联合于晓教授课题组应用其电生理手段,以及在华东师范大学李大力教授和刘明耀教授的基因敲除动物平台的支持下,对孤儿受体ADGRG2如何调控输出小管的重吸收进行了深入细致的研究。研究发现,ADGRG2和Gq在β-arrestin-1的帮助下与阴离子通道CFTR共定位在输出小管的特异性结构顶膜上,形成区域性信号转导复合物,并构成了快速的GPCR-离子通道的偶联,从而精确调控非纤毛细胞的氯离子电流以及小管的重吸收过程。ADGRG2细胞内环的第二个和第三个内环的特异性氨基酸位点决定ADGRG2与下游G蛋白偶联的选择性,并与小管的重吸收密切相关。不仅如此,在输出小管中ADGRG2,Gq,β-arrestin-1或者CFTR的表达水平下降或者功能缺失都会导致小管重吸收障碍和精子淤积;但这些障碍可被特异性的激活血管紧张素受体2-AT2所拯救。该研究结果不仅可以部分解释为什么许多有囊肿性纤维化的CFTR突变的病人常常伴随不育,也为一些男性不孕不育的治疗提供了新的理论基础和潜在方案。
本研究得到了金沙9001cc以诚为本首页生殖医学研究中心陈子江教授和秦莹莹教授的指导,金沙9001cc以诚为本首页生命科学学院徐志刚教授分子克隆的帮助,金沙9001cc以诚为本首页易凡教授,李景新教授和北京大学金沙9001cc以诚为本首页孔炜教授对在体实验的帮助。
金沙9001cc以诚为本首页基础医学院生物化学与分子生物学系博士生张道来,孙玉静,已毕业硕士生马明亮和王艺璟为该论文共同第一作者。金沙9001cc以诚为本首页于晓教授,孙金鹏教授和华东师范大学的李大力教授为该文的共同通讯作者。
文章链接:https://elifesciences.org/articles/33432